서론
간경화증 환자에서 흔히 볼 수 있는 만성 심기능 이상을 간경화성 심근병증이라 하며, 이는 1) 스트레스에 대한 적절한 수축기능 상실, 2) 이완기능 저하, 3) 전기생리학적 이상을 특징으로 한다[
1]. 간경화성 심근병증에서 보이는 이완기능 이상은 심근 내에 콜라겐의 축적과 관련이 있다고 알려져 있다[
2]. 이는 좌심실 비대로 이어져 심근의 강성(stiffness)이 증가하게 되며 그에 따라 심실 이완은 더욱 느려지고 불완전하게 된다. 간경화성 심근병증 각각의 특징과 간경화증 환자의 예후와 관련된 많은 연구가 보고되고 있으며, 특히 이완기능 저하와 간이식 후 예후와의 관련성에 대한 연구들은 최근 더욱 활발히 보고되고 있다[
3,
4].
하지만 이 연구들에서 적용한 이완기능을 나타내는 지표들은 연구마다 차이가 있으며, 그에 따라 유병률부터 큰 차이를 보이며 결과도 다양하게 나타나고 있다[
3,
5,
6]. 또한, 이완기능을 나타내는 대표적인 지표로 이용된 E/A ratio는 전부하에 따라 큰 변화를 보일 수 있는 단점이 있다[
7]. 이와 같이 이완기능에 대한 연구에 이용된 지표가 통일되지 않고, 각 지표 자체가 안고 있는 제한점이 있어 이를 보완할 필요성이 제기되고 있다.
Diastolic wall strain (DWS)은 선형 탄성 이론에 토대를 두고 좌심실 수축 기능에 이상이 없는 환자들에서 비침습적으로 확장능력을 평가하는데 유용한 지표로 알려져 있다[
8]. 즉, 이완기에 심실 벽을 얇게 하는 것(thinning)에 문제가 생기면 이완기 변형에 저항이 생기고 결과적으로 이완기 심근의 강성이 증가하게 된다. 이 지표는 심근의 강성이 증가하면서 이완기능 저하를 보이는 간경화성 심근병증에 적용하기에 적절해 보이지만, 이 새로운 지표를 간경화 환자에서 발생하는 이완기능 저하에 적용한 연구는 아직 없다.
따라서 저자들은 간이식 수술을 받은 환자들을 대상으로 수술 전에 시행한 심장초음파 검사를 통해 얻은 DWS가 간이식 수술 후 생존율을 예측할 수 있는지 확인하고자 하였다.
대상 및 방법
본 연구는 병원 윤리위원회의 승인을 받아 진행되었다. 2009년 10월부터 2012년 10월까지 간이식을 받은 1,178명의 말기 간질환 환자를 대상으로 후향적 연구를 시행하였다. 18세 미만, 수술 전 심장초음파 검사를 시행하지 않았거나 불완전하게 시행한 환자, 재이식을 받은 환자, 만성 신질환이 있는 환자, 심장 수술을 받은 과거력이 있거나 중등도 이상의 심장 판막 질환이 있는 환자 197명을 제외하고 남은 981명을 대상으로 하였다.
환자의 임상 정보와 검사 정보는 전자의무기록을 통해 수집하였다. 본 연구의 주 평가변수(primary endpoint)는 간이식 후 2년 생존율로 정하였다. 사망률 정보는 의무 기록과 병원 장기이식센터를 통해 갱신된 데이터베이스로부터 수집하였다.
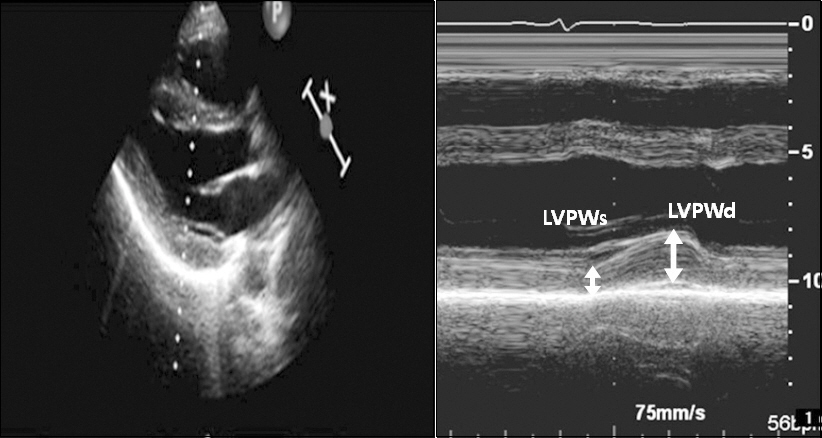
수술 전 경흉부 심초음파는 숙련된 심초음파 기사가 시행하였고 담당 심장내과 전문의가 확인하였다. 2.5 MHz 트랜스듀서가 있는 Hewlett-Packard Sonos 2500 or 5500 imaging system으로 2D, 도플러 그리고 조직 도플러를 측정하였다. 측정한 2D 변수에는 수축기말 좌심실 내경(end-systolic interventricular diameter [IVDs]), 이완기말 좌심실 내경(end- diastolic interventricular diameter [IVDd]), 수축기말 좌심실 후벽 두께(end-systolic left ventricular posterior wall thickness [LVPWs]), 이완기말 좌심실 후벽 두께(end-diastolic LV posterior wall thickness [LVPWd]), 좌심실 질량 지수(left ventricular mass index [LVMI]), 좌심방 내경(diameter of the left atrium [LA])이 있다. 단축분획률(fractional shortening)은 (IVDd-IVDs)/IVDd로 계산하였다. Teichholz 방법이나 biplane modified Simpson’s rule을 적절히 이용하여 이완기말 좌심실 용적(left ventricular end-diastolic volume [EDV])과 수축기말 좌심실 용적(left ventricular end-systolic volume [ESV])을 측정하였으며 이를 통해 심박출량(stroke volume [SV = EDV− ESV])과 좌심실 구출분획(left ventricular ejection fraction [LVEF])을 계산하였다. 각 측정치를 체표면적으로 나누어 각 측정치의 지표(index)를 계산하였다. 심첨 4방도(apical four-chamber view)에서 간헐파(pulsed-wave) 도플러를 이용하여 E와 A 그리고, E 파의 감속시간(deceleration time [DT]), E/A ratio를 측정하였다. 심중격쪽 승모판륜(septal mitral annulus)에서 조직초음파 이미지를 통해 수축기 s’, 이완기 e’과 a’을 측정하고 E/e’ ratio를 계산하였다. 수축기시 최고 삼첨판 역류압 차이(peak systolic tricuspid regurgitation pressure gradient)도 측정하였다. DWS는 다음과 같은 식으로 계산하였다(DWS = [LVPWs− LVPWd] / LVPWs) (
Fig. 1) [
8].
Fig. 1
Measurement of the diastolic wall strain (DWS) from M-mode echocardiography. Left panel: In parasternal long axis view, M-mode echocardiography of left ventricular posterior wall was measured. Right panel: Left ventricular posterior wall thickness at end systole (LVPWs) and left ventricular posterior wall at enddiastole (LVPWd) were indicated. DWS was calculated as follows: DWS = (LVPWs − LVPWd) / LVPWs.
모든 값은 평균 ± 표준편차, 중간값[사분위수범위] 또는 환자수(퍼센트)로 기술하였다. 정규분포를 따르는지에 따라, Student’s t-test, nonparametric Wilcoxon signed-rank test, chi-square test, 혹은 Fisher’s exact test를 적절히 선택하여 분석하였다. Univariate Cox proportional hazards analysis로 2년 사망률과 관련된 인자들을 확인하였다. Univariate Cox proportional hazards analysis에서 P 값이 0.05보다 작은 변수들을 Multivariate Cox proportional hazards analysis에 포함해 시행하였다. 이때 다중공선성 여부를 확인하기 위해 분산확대인자를 계산하였으며 다중공선성이 있다고 판단되는 변수는 제외했다. Kaplan-Meier method를 시행하여 DWS에 따른 생존률의 차이를 평가하였다. 통계적 방법은 SPSS software version 21.0 (SPSS Inc., USA)를 이용하였으며, P값이 0.05 미만인 것을 통계적으로 유의하다고 판정하였다.
결과
전체 대상군의 DWS 중간값은 0.38이었고 사분위수 범위는 0.33-0.43이었다. 이전 연구들[
8,
9]에서 사용했던 기준인 0.33을 중심으로 DWS가 0.33을 초과하는 군을 정상 DWS군으로 0.33 이하인 군을 낮은 DWS군으로 나누어 임상, 혈액학 및 심초음파 변수들에 대해 분석하였다(Tables
1 and
2). 정상 DWS군에 비해 낮은 DWS군이 통계적으로 유의하게 나이가 많았다. 낮은 DWS군에서 정상 DWS군에 비해 통계적으로 유의하게 LVMI가 더 컸고, fractional shortening, s’, E/A ratio, e’가 더 적었다. 다른 임상, 혈액학 및 심초음파 변수들은 유의한 차이가 없었다.
Table 1
Clinical Characteristics of the Study Patients
|
Variables |
All (n = 981) |
Normal DWS (< 0.33), (n = 658) |
Low DWS (≤ 0.33), (n = 323) |
P value |
|
Age (yr) |
52 (47-57) |
52 (46-57) |
53 (48-58) |
0.010 |
|
Male |
737 (75.1) |
494 (75.1) |
243 (75.2) |
0.958 |
|
Body mass index (kg/m2) |
23.7 (21.5-26.2) |
23.8 (21.7-26.1) |
23.6 (21.3-26.5) |
0.825 |
|
Hypertension |
135 (13.8) |
89 (13.5) |
46 (14.2) |
0.760 |
|
Diabetes mellitus |
219 (22.3) |
149 (22.6) |
70 (21.7) |
0.731 |
|
MELD score |
14 (10-23) |
15 (10-24) |
14 (9-22) |
0.265 |
|
Child-Turcotte-Pugh score |
8 (6-11) |
9 (6-10) |
8 (6-11) |
0.470 |
|
Child-Turcotte-Pugh class (A/B/C) |
273/333/375 (27.8/33.9/38.2) |
167/238/253 (25.4/36.2/38.4) |
106/95/122 (32.8/29.4/37.8) |
0.139 |
|
Cause of liver disease |
|
Virus-related cirrhosis |
620 (63.2) |
|
|
|
|
Hepatitis B/C virus |
577 (58.8)/43 (4.4) |
|
|
|
|
Alcoholic cirrhosis |
108 (11.0) |
|
|
|
|
Others |
253 (25.8) |
|
|
|
|
Donor type |
0.451 |
|
Cadaveric |
143 (14.6) |
92 (14.0) |
51 (15.8) |
|
|
Living |
838 (85.4) |
566 (86.0) |
92 (14.0) |
|
|
Laboratory data |
|
Hemoglobin (g/dl) |
10.5 (9.1-12.3) |
10.5 (9.1-12.2) |
10.6 (9.1-12.4) |
0.456 |
|
Platelet (×103/μl) |
58 (39-86) |
58 (38-85) |
59 (41-88) |
0.715 |
|
Total bilirubin (mg/dl) |
2.7 (1.3-9.9) |
2.8 (1.3-11.0) |
2.3 (1.3-9.4) |
0.452 |
|
Albumin (g/dl) |
3.1 (2.7-3.6) |
3.1 (2.7-3.5) |
3.2 (2.7-3.6) |
0.118 |
|
Creatinine (mg/dl) |
0.8 (0.6-1.0) |
0.8 (0.6-1.0) |
0.8 (0.7-1.0) |
0.853 |
|
Prothrombin time (INR) |
1.45 (1.21-1.88) |
1.45 (1.22-1.89) |
1.43 (1.19-1.88) |
0.993 |
|
BNP (pg/ml) |
49 (20-119) |
51 (22-117) |
47 (18-122) |
0.870 |
Table 2
Hemodynamic and Echocardiographic Data
|
Variables |
All (n = 981) |
Normal DWS (< 0.33), (n = 658) |
Low DWS (≤ 0.33), (n = 323) |
P value |
|
Hemodynamic data |
|
Systolic blood pressure (mmHg) |
110 (100-122) |
110 (100-121) |
111 (101-123) |
0.156 |
|
Diastolic blood pressure (mmHg) |
69 (62-77) |
69 (62-77) |
70 (62-77) |
0.755 |
|
Heart rate (beats/min) |
73 (63-84) |
73 (63-85) |
74 (63-84) |
0.937 |
|
QTc (ms) |
449 (430-470) |
451 (431-472) |
446 (426-466) |
0.185 |
|
Echocardiographic data |
|
LVEDV index (ml/m2) |
60.9 (51.8-71.6) |
61.5 (52.4-71.8) |
60.4 (50.9-71.5) |
0.379 |
|
LVESV index (ml/m2) |
21.7 (17.7-26.0) |
21.8 (17.7-26.1) |
21.4 (17.5-25.8) |
0.641 |
|
LVMI (g/m2) |
90.3 (78.4-103.7) |
88.4 (77.3-101.1) |
95.2 (81.9-110.8) |
< 0.001 |
|
PGsys (RV-RA) (mmHg) (n = 846) |
23 (19-27) |
23 (19-27) |
23 (19-27) |
0.924 |
|
Systolic function |
|
Fractional shortening (%) |
41.0 ± 6.4 |
42.3 ± 5.9 |
38.6 ± 6.6 |
< 0.001 |
|
LVSV index (ml/m2) |
39.0 (32.9-45.6) |
39.4 (32.9-45.6) |
38.1 (32.9-45.6) |
0.290 |
|
LVEF (%) |
64 (61-67) |
65 (61-67) |
64 (61-67) |
0.451 |
|
s’ (cm/s) |
8.4 (7.4-9.7) |
8.4 (7.5-9.8) |
8.2 (7.1-9.5) |
0.023 |
|
Diastolic function |
|
LA diameter index (mm/m2) |
22.7 (20.7-24.9) |
22.9 (20.7-25.0) |
22.3 (20.4-24.7) |
0.224 |
|
E/A ratio |
1.12 (0.89-1.38) |
1.13 (0.90-1.40) |
1.07 (0.85-1.35) |
0.017 |
|
DT (ms) |
203 (179-234) |
201 (176-234) |
205 (180-232) |
0.362 |
|
e’ (cm/s) |
7.5 (6.2-9.0) |
7.6 (6.3-9.0) |
7.3 (6.0-8.9) |
0.008 |
|
E/e’ ratio |
9.7 (8.0-11.9) |
9.7 (8.2-11.8) |
9.8 (7.9-11.9) |
0.500 |
|
Diastolic wall strain |
0.38 (0.33-0.43) |
0.40 (0.38-0.44) |
0.31 (0.27-0.33) |
< 0.001 |
DWS에 따른 Kaplan-Meier 생존곡선에서 간이식 후 2년 생존율은 양 군간에 유의한 차이를 보였다(14.6% vs. 10.0%, P = 0.038,
Fig. 2). 간이식 후 2년 생존율의 예측인자를 알아보기 위한 univariate Cox regression analysis에서 나이, model for end-stage liver disease (MELD) 점수, Child-Turcotte- Pugh 점수, 크레아티닌 수치, B-type natriuretic peptide (BNP), 심박수, LVEDV index, LVSV index, LVEF, E/A ratio, e’, E/e’ ratio, DWS가 관련이 있는 것으로 나타났다. Multivariate Cox regression analysis에서도 DWS가 나이, Child- Turcotte-Pugh 점수, 크레아티닌 수치, 심박수, LVEDV index, LVEF, E/e’ ratio와 함께 2년 생존율의 예측인자로 남았다(P = 0.048,
Table 3).
Fig. 2
Kaplan-Meier survival curves. The survival rate of patients with diastolic wall strain (DWS) ≤ 0.33 was significantly lower than those with DWS > 0.33 (log-rank test, P = 0.038).
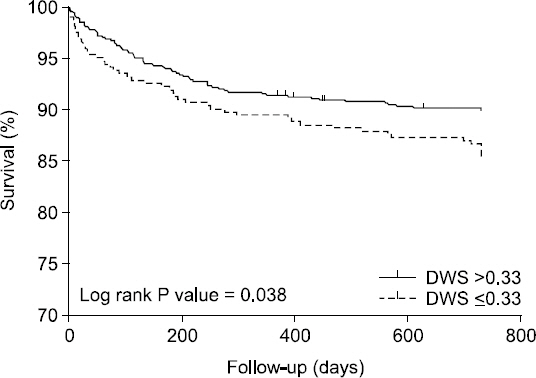
Table 3
Univariate and Multivariate Cox Regression Analysis of Predictors of Postoperative 2-years Mortality
|
Variables |
Univariate analysis |
Multivariate analysis |
|
|
|
Hazard ratio (95%CI) |
P value |
Hazard ratio (95%CI) |
P value |
|
Age (yr) |
1.06 (1.03-1.09) |
< 0.001 |
1.05 (1.02-1.08) |
< 0.001 |
|
Child-Turcotte-Pugh score |
1.21 (1.13-1.29) |
< 0.001 |
1.16 (1.06-1.26) |
0.001 |
|
Creatinine (mg/dl) |
1.08 (1.05-1.12) |
< 0.001 |
1.04 (1.00-1.08) |
0.028 |
|
BNP (pg/ml) |
1.00 (1.00-1.00) |
< 0.001 |
|
|
|
Heart rate (beats/min) |
1.02 (1.01-1.03) |
< 0.001 |
1.01 (1.00-1.03) |
0.035 |
|
LVEDV index (ml/m2) |
0.98 (0.97-1.00) |
0.006 |
0.99 (0.97-1.00) |
0.042 |
|
LVEF (%) |
0.95 (0.91-0.99) |
0.022 |
0.93 (0.89-0.97) |
0.001 |
|
E/A ratio |
0.35 (0.20-0.60) |
< 0.001 |
|
|
|
e’ (cm/s) |
0.84 (0.76-0.93) |
0.001 |
|
|
|
E/e’ ratio |
1.07 (1.03-1.10) |
< 0.001 |
1.06 (1.01-1.12) |
0.028 |
|
Diastolic wall strain (per 0.01) |
0.97 (0.95-1.00) |
0.027 |
0.98 (0.96-1.00) |
0.048 |
고찰
본 연구에서는 간이식 환자에서 수술 전에 시행한 초음파로 계산한 DWS를 중심으로 낮은 DWS군과 정상 DWS군을 나누어 보았을 때 낮은 DWS군에서 간이식 후 2년 생존율이 더 낮았으며, DWS는 나이, Child-Turcotte-Pugh score, 술전 크레아티닌 수치, 심박수, LVEDV index, LVEF, E/e’ ratio와 함께 간이식 후 2년 생존율의 독립적인 예측인자임을 밝혔다.
간경화 환자들에서 심부전을 보이는 경우가 현저하지는 않기 때문에 지금까지 간경화성 심근병증에서 이완기능 저하의 중요성은 의문시되어 왔다. 하지만, 간이식 후 심부전으로 예상치 못한 죽음에 이른 사례가 보고되고 있으며[
10], Moller and Henriksen [
11]은 이완기능 저하가 심할수록 간이식 후에 심부전이 오기 쉽다는 연구 결과를 발표하였다. 간이식 후 거의 25%에 달하는 환자들이 심혈관계 합병증을 겪는다고 알려져 있으며, 수술 중에 심기능 이상을 보이는 환자들에서 술후 폐부종의 위험이 더 높다는 연구 보고가 있다[
12]. 이처럼 간이식 수혜자에서 심기능의 중요성은 점점 부각되고 있다.
하지만, 간경화 환자들에서 심기능을 평가하기에는 몇몇 어려움이 따른다. 먼저 수축기능은 휴식기에는 전신혈관저항의 감소로 후부하가 줄어들어 과역동화 상태가 되기 때문에 정상 혹은 그 이상의 LVEF를 보인다. 본 연구에서도 전체 환자군의 LVEF 중간값은 64%이며 하위 4분위값도 61%로 정상범위에 있다. 또한 LVEF의 최저점도 54%로 모든 환자군에서 EF이 50% 이상으로 측정되었다. 이처럼 일반적인 기준으로 심장의 수축기능을 평가하게 되면 간경화 환자들에서는 수축기능 이상 환자를 만나기가 쉽지 않다. Carvalheiro 등[
13]의 연구에서도 LVEF < 55%인 간이식 수혜자는 오직 1.1%에 불과했으며, Josefsson 등[
14]의 연구에서도 LVEF < 50%인 간이식 수혜자는 3%뿐이었다. 두 번째로 이완기능은 보통 수축기능에 앞서 이상이 오는데 무증상인 경우가 많다. 간경화 환자들에서 심장 이완기능 이상의 유병률은 15-54%까지 다양하게 보고되고 있는데[
3,
5,
6], 이런 차이는 이완기능을 평가하는 지표와 기준의 다양함에서 기인한다. 주로 사용하는 지표로 E/A ratio가 있는데 이는 전부하에 의존적인 한계가 있으며[
7], e’은 이완기 중 팽창성(distensibility)보다는 이완(relaxation)을 주로 반영한다는 제한점이 있다[
15].
DWS는 심장의 이완 기능, 더 구체적으로 심근의 강성과 관련되어 있다고 최근에 알려진 지표이다. 이완기 동안에 심실벽이 얇아지는 정도를 측정하는 것으로 이완기 변형에 대한 저항을 반영하게 된다[
8]. Takeda 등[
8]의 연구에 따르면, DWS는 동물모델에서 침습적으로 측정한 심근 강성상수와 역의 상관관계를 보인다. 또한, Procollagen 1형을 통해 DWS가 심근 섬유화와 직접적인 관련이 있다는 연구결과도 있다[
16]. Ohtani 등[
9]은 LVEF는 정상이지만 심부전이 있는 환자에서 DWS가 낮은 경우 더 나쁜 예후를 보이며, 나이, 성별 등을 조정(adjustment)한 후에도 예후의 독립적인 예측인자임을 증명하였다. 간경화성 심근병증에서 보이는 이완기능 저하에서 심실의 강성이 주요 인자로 알려져 있고, 심근 강성이 증가하는 요인에는 심근비대, 부분적인 섬유화 그리고, 내피하 부종이 있다[
17-
19]. 따라서, 이에 대한 지표인 DWS가 심부전 환자에서와 마찬가지로 간이식 수혜자들에서도 예후를 예측하는 데 도움을 줄 수 있을 것으로 기대했다. 예상대로, 본 연구에서도 낮은 DWS (0.33 이하)군이 정상 DWS군보다 생존율이 낮았으며, DWS는 multivariate analysis에서 2년 생존율에 대한 독립적인 예측인자로 남았다.
DWS는 통상적으로 이용 가능한 심초음파 기계를 이용하여 2D 심초음파에서 측정한 지표를 이용하여 계산할 수 있다. 간이식 환자들에서 수술 전에 심초음파를 시행하는 경우가 대부분이라 추가적인 검사를 하지 않고도 DWS를 구할 수 있으며, 조직 도플러처럼 추가적인 소프트웨어가 필요하지 않고 2D 시행이 가능한 심초음파 기계라면 DWS를 구할 수 있으므로 경제적이다. 또한, 비침습적으로 측정할 수 있어 안전하다. 게다가, DWS는 전부하의 변화에 의해 영향을 받지 않아[
8], 지금까지 이완기능을 평가하는데 널리 이용되었던 E/e’ ratio, E/A ratio의 제한점을 보완할 수 있다.
본 연구는 여러 가지 제한점을 가지고 있다. 첫째, 본 연구는 후향적으로 진행된 연구이다. 나머지 혼란 변수들의 영향력을 완전히 배제할 수는 없지만, 선택 편향(selection bias)을 줄이기 위해 multivariate analysis를 시행하였다. 두 번째로 하나의 기관(single-center)에서 시행한 연구로서 간이식 수술 중과 수술 후에 그 기관의 환자 관리 프로토콜이 환자의 생존에 영향을 미쳤을 수도 있다. 세 번째로 심초음파 지표를 측정할 때 참여한 심초음파 기사와 심장 내과의가 다양하기 때문에 이에 따른 관찰자간 편차가 있을 수 있다. 네 번째로 생존율 예측능력에 대한 기존의 이완기능 지표들과의 직접적인 비교는 이루어지지 않아 DWS의 생존율 예측능력이 그들보다 더 낫다고 말할 수는 없다. 이에 대한 추가적인 연구가 필요할 것으로 생각된다.
결론적으로 쉽고 간편하게 심장의 이완기능을 평가할 수 있는 지표인 DWS는 간이식 수혜자들의 2년 생존율에 대한 독립적인 예측인자로 사료되며, 이는 기존에 알려진 E/e’ ratio, E/A ratio의 제한점을 보완함으로써 심기능 평가가 쉽지 않은 간이식 수혜자들의 생존율을 예측하는 데 유용하게 이용될 것으로 생각된다.










