개두술후 통증 치료
The treatment of postcraniotomy pain
Article information
Abstract
Postoperative pain is under-treated, and especially postcraniotomy pain is under-treated due to the fear of missing postoperative neurologic complications, and the fear of increased intracranial pressure secondary to elevated arterial carbon dioxide tension caused by respiratory depression. However, it continues to be commonly observed, is frequently severe, and if unrelieved, it may cause distress for the neurosurgical patients and serious complications in the operated brains. Many contributing factors affect postcraniotomy pain, including anatomical, surgical, anesthetic, and patient related factors. Diverse modalities are used for relieving the pain such as certain surgical techniques, nerve and scalp blocks with local anesthetics, many drugs – nonsteroidal anti-inflammatory drugs, gabapentinoids, N-methyl-D-aspartate antagonists, and opioids, but individually none of these modalities have been proved to be the best and universally applicable. For proper treatment and management of postcraniotomy pain, it is necessary to have a patient oriented, evidence-based, well-organized guideline for neuroanesthesiologists, neurosurgeons, and postcraniotomy patients.
서론
수술과 동반되는 조직손상과 염증은 통증을 동반한다. 수술 후 통증을 어쩔 수 없는 수술부작용으로 간주하여 제대로 치료하지 않으면 정상적인 회복이 어렵고, 재활치료에 적극적으로 참여할 수 없다. 때문에 퇴원이 지연되거나, 만성수술후통증으로 진행하는 등 좋지 않은 결과를 초래한다고 알려져 수술 후 통증치료에 관심을 기울이게 되었다[1]. 통증의 기전, 생리, 약리 등에 대한 이해가 늘어나고 급성통증관리(acute pain service)가 널리 보급되고, ‘통증은 다섯 번째 활력증후’라는 각성과 여러 지침들- 특히 수술에 따라 달라지는 진통지침을 인터넷에서 확인할 수 있는 PROSPECT guideline을 제정하거나, 환자자가조절장치(patient-controlled analgesia, PCA) 등 새로운 기구와 방법이 도입되었다[2]. 하지만 수술 후 통증은 제대로 치료되지 않고, 수술과 관련된 문제가 된다. 2011년 미국 국립보건원의 보고에 따르면 수술 후 80%의 환자가 통증으로 고생하지만 50% 미만에서만 충분한 통증치료를 받았고 이 통계는 10년 전, 20년 전과 비교하여 크게 달라지지 않았다고 한다[3].
개두술 후에 60–90%의 환자에서 고혈압(postcraniotomy emergence hypertension)이 생기는데, 원인은 통증과 교감신경계항진에 따른 카테콜라민 분비증가, 말초혈관수축, 압수용체 민감성 감소, renin-angiotensin-aldosterone 통로의 활성화와 뇌에 직접적인 조작이 가해져서 생기는 신경성 고혈압(neurogenic hypertension) 등이다[4]. 이로 인해 두개강내 출혈의 위험이 4.6배 증가하여[5], 병변주변에 혈종이 만들어지고 뇌부종과 뇌압상승이 발생하는데[6,7], 수술 후 뇌혈관장벽 파괴와 뇌혈관마비에 의한 뇌혈류자동조절 기능의 장애는 이 현상을 악화시키므로, perdipine 등의 항고혈압제로 적절히 치료해야 한다.
개두술후 통증을 적절히 치료하지 않으면 고혈압 외에 초조, 떨림, 오심과 구토 등의 합병증이 생기고 이로 인해 고혈압은 악화되며[8], 만성개두술후두통(chonic postcraniotomy headache)으로 발전하여 입원기간이 연장되고 치료비가 늘어날 수 있기 때문에[9] 적극적인 치료가 필요하다. 하지만 오랫동안 개두술후 통증치료에 무관심했다. 그 이유는 신경해부학적으로 뇌에는 통각섬유가 없고, 뇌막에서는 주로 동(sinus)주위에 분포하고, 두피 절개선과 신경주행이 일치하여 신경손상이 적어 수술부위로부터의 통증이 적다는 것과[10], 머리라 상대적으로 동작에 따른 아픔이 덜하다는 것 등이다[11]. 또 마약류진통제 투여로 인해 발생하는 축동, 오심, 구토 등의 부작용이 신경학적 이상으로 인한 것과 구별하기 어렵고, 또 다른 부작용인 호흡저하로 인해 탄산가스농도가 높아지고 이에 따른 뇌혈류량과 뇌압이 상승하여 뇌의 기능이 나빠질 수 있다는 걱정 등으로 이들 약제의 사용을 꺼리는 것도 있다. 또 관습적으로 통증보다는 뇌기능검사를 중요하게 여겨온 것과 이를 뒷받침하는 회복실에서 측정한 개두술 후의 통증점수가 안면부나 요부 후궁절제술(lumbar laminectomy) 후와 비교하여 낮았다는 연구결과도 기여하였다[10].
1995년 Stoneham과 Walters가[12] 영국의 뇌신경마취과의사들을 상대로 개두술후 통증에 대한 설문조사를 발표한 후, 개두술후 통증의 발생빈도와 원인 통증치료방법과 효과 등에 대한 여러 연구들이 발표되었는데[8,13-17], 개두술후 환자의 41–85%가 48시간 안에 중등도 이상의 통증을 경험하고 과반수가 진통효과에 불만족하며, 상당수가 1년 후에도 지속된다는 것으로, 일반 수술 후와 같이 최근의 보고도 큰 차이가 없다. 개두술후 통증치료를 위해 다양한 약물들(codeine, morphine, fentanyl, oxycodone, tramadol 등의 opioids, acetaminophen을 포함한 nonsteroidal anti-inflammatory drugs [NSAIDs]와 α2-agonists, gabapentinoids, N-methyl-D-aspartate [NMDA] antagonists)을 다양한 경로(근육주사, 정맥주사, 경구투여, PCA)로 사용하고, 국소마취제를 두피에 직접 침윤하거나 두피신경을 차단하기도 하는데, 환자의 수술 전 상태와 수술의 종류와 방법, 수술 중 사용한 마취약제 등에 따라 수술 후 통증의 빈도, 강도, 성격이 다르기[18] 때문에 수술 전에 환자에 맞는 마취관리와 수술 후 통증관리 계획을 수립하는 것이 필요하다고 하겠다.
개두술 후 통증관리를 위하여 통증의 양상, 유발시키는 다양한 원인과 기전, 발생빈도와 강도에 영향을 끼치는 요인들을 살펴보고 치료에 이용되는 약제들과 기법을 문제점과 더불어 소개하며, 합리적인 치료지침의 필요성을 알아보고자 한다.
통증의 성격
통증의 양상은 긴장성 두통과 비슷하게 박동적(pulsating), 압박적(pounding)이나 찌르는 듯하고 간혹 작열통 같은 것이 일정하게 연속적으로 보이는 것으로 절개된 두피와 근육, 피하조직에서 유래된 체성통증이다. 병태생리는 수술 중에 생기는 두피, 근육, 골막, 뇌막과 신경의 물리화학적인 손상, 뇌척수액의 누출, 경막의 당겨짐, 무균성 뇌막염과 경부근육과 골막의 유착 등 여러 요소가 관여하는데 그 중 근육의 손상 정도가 큰 영향을 끼친다. 이차적으로 중추감작과 통각수용기신호의 증폭이 촉진되어 만성개두술후두통으로 발전하기도 한다[19]. 개두술후 통증의 발생빈도와 정도에 영향을 주는 여러 요인들이 보고되었는데, 환자요인으로 환자의 나이가 많아질수록(한 해에 통증점수 3%씩 혹은 0.18점씩 감소[16,20]) 통증을 덜 느끼고, 75세 이후에는 수술부위에 약한 통증을 호소한다[21]. 보고에 따라 차이는 있지만 대체적으로 여성이 40% 더 심하게 많이 아파하고, 또 수술 전부터 통증을 치료하기 위해 마약류를 복용한 환자에서 발생빈도가 높았다[21]. 수술관련 요인으로 전두골과 두정엽의 수술이 다른 부위에 비해 통증이 덜하였고[15], 천막하(infratentorial) 수술이 천막위(supratentorial)수술보다 통증의 발생빈도가 높았고, 접근 방법에 따라 측부후두하절제술(lateral suboccipital craniectomy)후에 통증의 강도가 높았는데[21] 이 부위의 근육이 경막과 유착되거나 뼛조각이 지주막하에 남아있거나, 절개과정에서 발생하는 근육손상 그리고 후두신경이 눌리거나 신경종이 잘 생기기 때문이고, 개두술이나 두개성형술을 한 경우 통증의 발생이 줄었다[12,22]. 경막성형술을 실시하여 경막의 장력을 줄이면 두통의 빈도를 줄일 수 있는 것으로 미루어[23] 부위 자체보다는 수술과정에서 생기는 조직의 손상 정도가 통증에 영향을 주는 것으로 보인다. 마취관련요인으로 마약류와 함께 투여된 흡입마취제와 전정맥마취제(total intravenous anesthesia, TIVA)를 비교할 경우 투여시기를 적절히 조절하면 차이가 없다고 하나, sevoflurane의 경우 remifentail과 propofol을 이용한 TIVA보다 147% 통증빈도가 높았고[16], remifentanil은 급성 마약류내성(acute opiod tolerance)과 통각과민(hyperalgegia)이 생겨 fentanyl이나 sufentanil에 비해 진통제의 투여시간을 앞당겼다[24-27]. Remifentanil을 지속정주하고 경막 봉합할 때 합성마약제인 piritramide를 투여한 군을 fentanyl을 간헐적으로 투여한 군과 비교한 경우 마취각성과 발관시간에는 차이가 없었고, 술 후 통증의 강도와 진통제의 요구량은 높아졌다[28]. 수술 중 corticosteroids를 투여한 경우 통증발생을 낮출 수 있었다[9].
2015년 뇌종양수술환자 대상의 최신보고는 치료에도 불구하고 수술 후 48시간 이내에 60–96%가 중등도 이상의 통증을 경험하여 통증의 빈도는 여전히 높았고, 수술 후 12–24시간 사이에 발생 빈도와 강도가 가장 많았으며[29], 수술 후 4일에도 높은 빈도를 보였는데, 이때는 환자가 거동을 시작한 시기였다[30].
두부의 해부와 신경 분포
두개골의 윗부분은 뇌를 담아 보호하는 상자모양으로, 아래는 움직이는 하악이 붙은 안면골로 되어있다[23]. 시상봉합(sagittal suture)으로 연결된 좌우 두 개의 마루뼈(parietal bone)는 이마에 해당하는 전두골과는 관상봉합(coronal suture)으로, 뒤통수뼈(occipital bone)와는 삼각봉합으로 이어져 두개관이 된다. 이것을 들어내면 전, 중, 후두개와로 구성된 두개저가 있는데, 여러 종류의 복잡한 구멍들로 구성되어 있다. 두개골의 골막은 안쪽의 섬유질막(fibrous membrane)인 경뇌막(endocranium)과 바깥쪽의 두개골막(pericranium)으로 두개골을 싸고 경뇌막은 뇌경막(brain meninges)과 이어지고 두개골막은 두피의 가장 안쪽이 된다. 두개의 두개표근(epicranial musculature) 후두전두근(occipitofrontalis)과 측두두정근(temporoparietalis)과 이를 연결하는 두정부의 모상건막(galea aponeurotica)이 두개정(epicranium)이 된다.
두피는 다섯 층(바깥으로부터 피부, 피하조직 [fat and fibrous tissue], epicranium, subaponeurotic areolar tissue, periclanium)이다[31]. 두개골을 싸는 막은 골내막과 뇌막으로 이루어져 뇌를 둘러싸서 보호하는 기능 외에 혈관과 신경이 분포하고, 일부가 합쳐져서 수막정맥동이 만들어지며 대사작용과 감각을 담당한다[32].
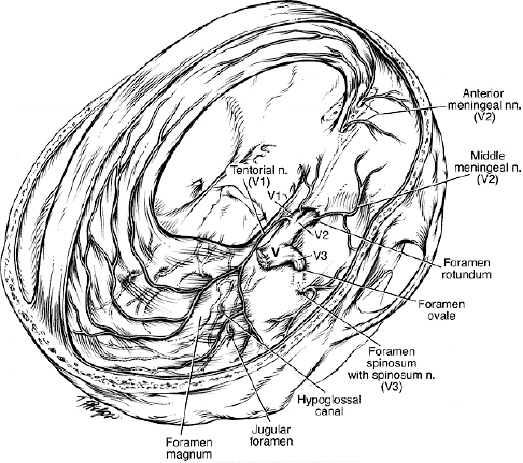
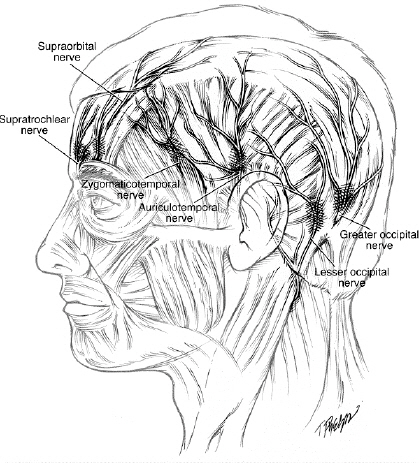
뇌막은 경막, 지주막, 연막으로 이루어지고 그 중 경막은 골막층과 뇌를 지지하는 막으로 구성되어 대뇌겸, 소뇌겸 (falx cerebri and cerebelli), 소뇌천막(tentorium cerebelli)과 안장가로막(diaphragm sellae)이 된다. Fig. 1은 경막의 신경분포를 보여준다. 전, 중두개와의 경막은 삼차신경의 제1분지(안신경)에서 나온 앞, 뒤사골신경(ant. & post. Ethmondal nerve)이 분포하고 중와에서 두정부(parietal area)와 접형골(sphenoid bone)의 소익(lesser wing)에는 삼차신경 2분지인 상악신경의 중경뇌막신경(nervus, meningeus medius)이, 측궁융부(lateral convexity) 근처의 중두개와에는 3분지의 극공신경(nervus spinosus)이 분포하는데[31] (Fig. 1) 이 신경들은 A-β섬유이며, calcitonin gene-related peptide, substance P, neurokinin A같은 혈관작용성 신경펩티드(vasoactive neuropeptide)를 분비한다. 소뇌겸과 대뇌겸, 위시상 및 횡정맥동(superior sagittal and transverse sinus)에는 안신경의 분지에 해당하는 nervus tentorii of Arnold, tentorial nerve가 후두개와에는 1, 2, 3 목신경(cervical nerve)과 상목교감신경절(superior cervical ganglion)이 주로 담당하고 안면신경과 설인신경 미주신경의 회귀신경의 일부 가지도 분포한다. Fig. 2에서 보듯이 두피와 골막의 신경분포는 삼차신경의 안신경분지에서 나오는 안와위신경, 활차상신경과 상악신경분지에서 협골측두신경, 하악신경분지에서 이개측두신경과 2,3번 목신경의 전지(ventral rami)로 구성된 작은 뒤통수신경(lesser occipital nerve), 2,3번 목신경의 배지(dorsal rami)로 이뤄진 큰 뒤통수신경(greater occipital nerve), 3번 목신경 배지의 내측표재분지인 제삼목신경(third occipital nerve)과 목교감신경, 미주신경의 일부, 설하신경의 일부, 안면신경과 설인신경의 일부가 분포한다[23]. 수술부위에 따라 접근법이 각각 다른데 천막상개두술을 위해서는 여러 방법의 천막상접근이(Table 1) 골저부분 수술을 위한 다양한 고전적 접근법이나(Table 2) 측면접근법을(Table 3) 실시한다[23].
통증치료
마약류
마약류는 중추 및 말초신경과 장에 널리 분포하는 G-protein-couple과 반응하는 수용체(μ, κ, δ)와 결합하여 작용을 나타낸다[33]. 그 중 μ수용체는 각각 μ1, μ2, μ3으로 나누고, μ1은 척수위진통(supraspinal analgesia), μ2는 호흡과 장운동을 저하시키며, μ3는 소염작용을 담당하는 것으로 알려졌다[34]. 개두술후 통증치료에 이상적인 진통제는 의식이나 호흡에 영향을 주지 않으면서 오심과 구토, 출혈 없이 충분한 진통작용이 있는 것이다. 그들 중 무슨 약을 어디로 얼마나 투여할지는 환자의 심신상태와 약제의 확보 그리고 의사의 기호에 좌우되는데, 구체적인 고려사항은 통증의 세기, 환자의 나이와 건강상태, 약물복용여부, 과거 투약경험, 전신마취제로 투여한 약제 등이다[21]. 환자의 요구가 있을 때 주거나 PCA를 이용하는데, 후자가 더 효과적이고 안전한 방법이다. 부작용은 오심과 구토, 진정, 가려움, 축동, 변비, 뇨저류, 약물저항과 의존(drug tolerance and dependency), 호흡저하 등이 있다. 호흡저하는 연수의 호흡중추를 직접억제하기 때문으로, 호흡억제에 의해 탄산가스가 축적되면 뇌혈류량이 늘어나고 이에 따라 뇌압이 상승하여(일명 luxury-perfusion 현상) 뇌내유순도가 떨어지므로 수술 후 민감한 상태의 뇌가 더 나빠지기 때문에[35,36] 주의하여야 하고 naloxone을 사용하여 길항할 수 있다. 마약류는 천정효과가 없기 때문에 진통효과를 내기 위한 각 약물의 용량이 다르고(equipotent dose) 그때 발생하는 부작용은 일정하다[21].
Codeine
Codeine은 μ수용체에 결합하고 호흡저하가 적고 신경학적 검사에 영향을 끼치는 축동이 없어서, 개두술후 통증치료에 초기부터 우선적으로 사용하였다[33]. 1995년 영국에서 실시한 설문조사에서 열명 중 거의 아홉 명의 뇌신경마취과의사가 첫 번째 진통제로 선택하였고, 10년이 지난 조사에서도 여전히 많은 수가(78%) 우선적으로 선택 하지만[37,38], codeine의 진통작용은 충분하지 않다. 3-O-methyl-morphine인 codeine은 cytochrome P-450 CYP2D6의 작용으로 메틸기가 떨어져 모르핀으로 바뀌어 효과가 나타나는데, 근육주사로 투여한 5–15%만이 바뀌고, 이 효소는 반응의 차이가 서로 다른 두 종류가 있어서 각자가 가진 효소에 따라 진통작용이 다르게 나타난다. 또 이 효소의 작용을 길항하는 약물(quinidine, fluoxetine 등)을 함께 투여한 경우에도 효과가 현저히 떨어진다. Codeine을 정맥주사를 하면 심한 저혈압이 발생할 수 있어 근육주사나 경구투여를 하는데, 혈중농도를 예측하기 어렵고, 근육주사를 반복하면 주사통이 생겨 효과가 줄기도 한다. 30–60 mg 복용하거나 근육 주사한다.
Morphine
Codeine보다 효과적이면서 10배 강력한 진통작용을 가진 morphine은 진정작용과 그에 따른 호흡저하 등의 부작용으로 개두술후 통증치료에는 사용하지 않았다. Stoneham 등[39]이 codeine 60 mg 근육주사와 morphine을 PCA로 주사한 경우를 비교하였는데, 진통작용이 약간 좋았으나 부작용(오심과 구토, 호흡저하, 축동 등)은 비슷하였다. Gottschalk 등[20]은 천막하개두술 후에 codeine 60 mg와 morphine 10 mg 근육주사를 비교하였는데 morphine 쪽이 제통 효과가 좋았고, 부작용은 차이가 없어 개두술후 통증치료에 적합한 것으로 발표하였다. Codeine과 비교하여 부작용의 위험을 증가시키지 않으면서 효과작인 진통작용을 보여서 중등도 이상의 통증에 선호되며 서로 작용기전이 다른 paracetamol이나 NSAIDs (diclofenac, ketorolac 등)를 함께 사용함으로 morphine의 투여 총량과 부작용을 줄일 수 있는 다양한 진통기법(multimodal analgesic techniques)과 PCA를 이용하면 더 안전하고 효과적으로 통증을 조절할 수 있다. Morphine은 0.1 mg/kg씩 정맥, 근육, 피하주사 하는데 작용시간은 3–4시간이고, PCA의 경우 1.5 mg을 매 8분마다 투여하되 4시간 동안의 용량이 40 mg을 초과하지 않도록 조절한다. 또 경구투여용으로 20 mg/ml의 시럽이나 15, 30 mg 알약, 서방정도 있는데 주사할 때 보다 3–5배 용량을 증가시켜야 한다.
Fentanyl
Fentanyl도 morphine처럼 μ수용체에 작용하며 morphine보다 100배 강한 진통효과가 있으나 진정이나 수면작용은 없고, 지용성으로 작용이 빠르게 나타나 수술 중 흡입마취제의 보조제로 사용된다. 작용시간이 비교적 짧기 때문에 수술 후 진통은 PCA를 이용한다. 천막상개두술 통증 치료를 위해 fentanyl과 ketorolac을 PCA와 필요에 따라 주사했을 때의 효과를 비교하였는데 PCA를 사용한 경우가 부작용 증가 없이 더 많은 양을 투여하여 진통효과를 높였다[40]. 또 천막하개두술 후에도 PCA를 사용한 경우가 필요에 따라 투여했을 때보다 많은 량을 부작용 없이 사용하여 좋은 진통을 하였다[41]. 또 morphine에 비해 인지기능이 비교적 잘 유지되는 것으로 알려졌다. 25–50 μg을 1–2시간 간격으로 혹은 25–100 μg/h로 주사하고 최근 일정량이 피부로 흡수되도록 만든 경피부착포(transdermal patch) 형태의 제품을 만성통증치료에 사용하는데 개두술 후 통증에도 적용할 수 있을지는 연구가 필요하다.
Methadone은 마약의존이나 중독 환자를 치료하거나 회복시키는데 사용하였는데, 난치성 통증이나 수술 후 통증에도 이용이 확대된 약으로 내복으로 약효발현이 좋고 반감기가 길다. 또 NMDA 수용체 길항작용이 있어 만성, 신경병증성 통증(neuropathic pain)에 효과가 있는데, morphine과 같은 역가를 보이므로 4–8시간 마다 5–10 mg 정주하거나 10 mg을 복용한다[21].
Oxycodone과 hydrocodone은 3–4시간 마다 5–10 mg 경구 복용하는 약제로 morphine과 유사한 정도의 진통효과와 호흡저하를 유발한다. 5 mg 알약이나 약제의 지속시간을 늘리기 위한 서방정 형태로 acetaminophen와 섞은 약을 만들기도 하는데(acetaminophen 500 mg 혹은 325 mg+oxycodone 5 mg) 개두술 직후 통증치료로는 적합하지 않고, 경구투여가 가능해지면 사용하는 것이 효과적이다. Hydrocodone은 10 mg, 25 mg 알약이나 각각의 약을 acetaminophen 500–650 mg과 섞은 형태로 만든다.
Tramadol
합성 μ-agonist로 신경말단에서 noradrenaline과 serotonin 흡수를 방해하여 신경간극에서 두 물질의 농도를 높이는 작용을 한다. morphine의 10% 효과를 보여 주사를 반복하여도 의존성과 천장효과가 없고, 마약류에서 흔히 보이는 호흡저하도 적고, 심혈관계나 호흡계의 기능이 나쁜 환자도 사용할 수 있어서 수술 후 통증에 적합한 약제로 사용하였으나 오심과 구토를 상당히 증가시키는 단점이 있다. 단독으로 사용한 경우 진통효과가 다양하다고 보고되는데, 정주한 경우 모르핀과 비슷한 진통작용을 보인다고 하나, 50–75 mg을 근육 주사한 경우 연구를 중단할 정도로 진통효과가 적고, 경구투여도 효과가 미미하였다[37]. 용량을 늘려 하루 두 번 100 mg을 근주한 경우 통증점수를 줄이고, 마약제재의 요구량과 오심, 구토 치료제의 요구량을 줄였다는 보고도 있다[42]. 하지만 대다수의 보고는 오심과 구토의 발생을 증가시키고 경련을 일으킬 수 있어 천막위수술에는 사용이 권장되지 않는다[36].
비마약성진통제
Nonsteroidal anti-inflammatory drugs
마약류에 비해 약한 진통작용과 해열작용을 하는 프로스타글란딘(prostagladine) 합성을 저해하는 콕스(cyclooxygenase, COX) 1, 2길항제인 NSAIDs, paracetamol 등이 있는데, 천장효과가 있고, codeine, oxycodone, hydrocodone과 섞은 약들을 진통제로 사용하기도 한다.
Aspirin은 혈소판작용을 비가역적으로 길항함으로 수술 후 출혈을 유발시킬 수 있어 사용하지 않으나 혈소판에 영향을 적게 주는 choline-magnesium trisalicylate (trilisate)를 만들어 수술 후 통증치료에 사용하기도 한다[22].
Acetaminophen는 중추신경계에 작용하여 하행성 세로토닌 통로(descending serotonergic pathways)를 활성화하고, COX-3에 작용하거나 cannabinoid 수용체에 반응하는 물질을 합성함으로 cannabinoid 작용제로 작용하여 진통효과를 나타낸다[43]. 또 척수의 NMDA 수용체가 관여하는 통각작용을 방해하여 결과적으로 척수의 산화질소(nitric oxide, NO)작용을 길항한다[43]. 항염, 항혈소판작용이 없고, 위장관계 손상과 심, 신장에 부작용이 없는 해열, 진통작용으로 수술 후 통증치료에 비교적 안전하게 사용할 수 있지만, 진통효과가 적어 단독으로 투여하기 보다 마약류와 함께 사용하는 것이 좋다. 내복약과 주사약이 있고, 하루에 성인 7.5 g, 소아 150 mg/kg 이상 투여하면 간독성을 유발하므로 용량제한이 필요하다[23]. NSAIDs는 COX를 길항하여 프로스타글란딘 합성을 방해하는데, COX의 두 동종형이 있는데, COX-1은 신장, 장점막, 혈소판 내피에 존재하여 항상성 유지에 중요한 역할을 하며 COX-2는 염증부위의 프로스타글란딘 합성에 관여하여 염증반응과 통증을 유발시키는 역할을 주로 하는데 NSAIDs의 항염증작용은 COX-2를 통해서, 출혈성 증가, 위장관 질환, 신부전 등의 부작용은 COX-1을 통해 나타난다[43]. COX-2 선택길항제는 COX-2에 주로 작용함으로 위의 부작용에서 비교적 자유롭지만 혈전을 형성하여 심각한 뇌, 심혈관계질환을 유발하여 rofecoxib를 포함한 대부분의 약제가 시장에서 퇴출되었고, 주로 celecoxib를 사용한다[44]. Ibuprofen과 diclofenac도 혈전에 의한 심혈관계 질환의 위험성을 높인다[44].
비마약성진통제는 마약류와 병용하여 통증정도와 마약류의 사용량과 부작용을 줄인다. 수술 후 통증조절을 위해 Acetaminophen, NSAIDs, COX-2 선택길항제를 morphine과 병용했을 때의 효과에 대한 메타분석에서, morphine 사용량을 15–55% 줄였고[44,45], NSAIDs는 통증의 강도와 morphine투여에 따른 부작용(오심, 구토, 진정)도 줄였으나, 심각한 출혈위험을 1.7% 올렸고, COX-2 선택길항제의경우 심장병환자에서 신장질환의 발생을 1.4% 증가시켜 병용이 옳은가에 대한 의문이 제기되었다[46]. 소아 개두술후 진통제로 paracetamol과 ibuprofen을 각각 10 mg/kg씩 2시간 간격으로 투여한 경우 별다른 부작용 없이 통증점수와 마약류, 항구토제의 요구량을 줄일 수 있었으나[47], 성인에서 천막위수술후 투여한 parecoxib 40 mg는 진통 및 마약류 절약효과가 없었다[48].
항경련제
항경련제는 국소마취제와 더불어 정상전도에 영향을 주지 않고 비정상적인 이소성 흥분을 억제하는데, 이소성 과흥분은 나트륨 통로의 분포가 변하면서 전기생리적 특성이 변하기 때문에 발생한다. 이소성 흥분이 통증으로 변하는 기전은 우선 비정상적인 다량의 구심성 흥분이 중추신경계로 전달되거나, 보통에서는 흥분을 일으키지 못하는 작은 자극에 반응이 나타나고, 통각수용체를 통한 비정상적인 구심자극이 중심성 민감화를 일으켜 통각수용체를 통하지 않은 자극에도 통증을 일으킨다.
Gabapentin은 1995년 유통된 항경련제로 항통각과민(antihyperalgesic), 항이질통(antiallodynic)작용이 있어 신경병증성 통증에 효과가 있다고 알려졌고 최근에 gabapentin 보다 10배 강력한 pregabalin도 생산되었다. 항통각과민 작용기전은 손상된 조직으로부터의 구심성 전도를 줄이는 기존의 진통제와는 달리, 조직손상으로 비정상적인 중심감작이 일어난 척수후각의 흥분성 항진을 낮추는데, 이름과는 달리 GABA 수용체와는 무관하게 전압의존칼슘통로(voltage dependent calcium channel)의 α2δ subunit에 결합한다. 신경병증성통증 통증에 관련된 NMDA수용체나 다른 수용체와 후각뉴런과 결합하거나, Na, Ca 통로, monoamine 통로와 마약류와 반응하며[49,50] 당뇨병성신경통이나 대상포진후 신경통에 효과적이다. 선행진통(preemptive analgesia)효과와 관련되어 수술 후 통증 치료에 효과가 있다고 알려졌는데, 수술 1시간 전에 gabapentie 1.2 g을 복용한 경우 복부자궁적출술, 척추수술 후 통증강도와 진통제용량을 낮췄고, 복부자궁적출술 후에는 오심 발생도 낮췄다[51]. 또 전신마취에 사용한 마약류의 과민을 줄여 필요량을 줄이고[52] 주술기에 gabapentin과 pregabalin을 투여함으로 만성수술후통증으로 이행하는 것을 막을 수 있다[53]. 개두술후 통증과 관련된 연구로 간질치료제로 수술 전 10일간 투여한 gabapentin과 phenytoin의 효과를 비교한 결과 gabapentin으로 치료한 경우에 수술 중 마취제의 사용량, 수술 후 통증점수를 낮췄고, 첫 진통제 투여시간을 늘렸으나, 진정작용이 의미 있게 증가하였고 기관내발관 시간도 늦어졌다[54]. 또 수술 전에 일회성 투여는 개두술후 진통에는 효과 없이, 기면, 졸림, 구역 등의 부작용이 발생하여 신경학적 검사를 어렵게 하므로 권장하지 않는다.
α2-agonists
주로 시넵스 이전에 존재하여 시냅스 틈새로 NE이 분비되는 것을 억제하는 음성되먹임기전과 교감신경유출을 감소시키고 중추신경에 작용하여 진정작용을 하는데 clonidine과 dexmedetomidine이 있다. clonidine은 전신마취 할 때 약제의 요구량을 줄이거나, 척추마취에 혼합하여 작용시간을 연장하거나 효과를 증가시킨다고 알려졌고, dexmedetomidine은 더 선택적인 α2-agonist로 진정작용이 강하고 상대적으로 호흡억제가 적어 각성머리뼈절개(awake craniotomy)나 기계적 환기에 사용하고[55], 뇌수술 후에 흔한 불편함과 초조함을 치료하는데 적합한 것으로 알려졌다[21]. 주술기에 사용하면 각성시간의 연장 없이 수술 후 통증의 강도와 진통제의 요구량, 오심을 줄일 수 있다고[56] 하지만 부작용으로 저혈압과 서맥을 유발할 수 있어서 뇌 수술 후 통증치료를 위해서는 잘 사용하지 않는다.
스테로이드
스테로이드는 프로스타글란딘 합성을 방해하고 혈중 endorphin을 높이므로 소염작용과 기분상승(mood elevation)이 있는데, 뇌수술 도중 만들어지는 뼛가루 등에 인한 뇌경막의 물리화학적 염증반응을 줄임으로 스테로이드를 사용하지 않은 환자에서 수술 후 통증의 강도가 119%로 증가되었고[27] 수술 후 오심과 구토의 빈도를 낮추는데 효과적이다. Dexamethasone 5–10 mg 한번 주사로도 효과가 있으며, 뇌부종을 치료하기 위해 수술 전에 장기간 사용하기도 한다[23].
NMDA inhibitors
정맥마취제인 ketamine은 중추감작을 줄임으로 만성통증에도 효과적인데, 마약류에 의해 발생하는 마약류 내성과 통각과민을 줄이는 예방진통작용(preventive analgesia)이 있는 것으로 알려졌다[21,52,55]. 소량(0.05–0.2 mg/kg/h)을 점적 주사하는데 뇌압을 높이고 오심과 구토가 심하고 진정작용이 강해서 개두술후 통증조절에는 부적합하다.
국소마취제
국소마취제는 voltage-gated Na+ channel을 억제하여 임펄스 전도(impulse conduction)를 막음으로 활동전위(action potential)을 유발시킬 정도의 역치전위(threshold potential)을 만들지 못하게 한다. Lidocaine 정맥주사로 마취제의 필요량을 줄이기도 하고 만성통증으로의 이행을 막기도 한다.
두피신경차단(regional scalp block)과 국소마취제 침윤(local anesthetic infiltration) 두피신경차단은 두피에 분포한 신경 전부를 23, 26G 바늘을 이용해 국소마취제 1–5 ml씩 주사하고[31,57,58] 국소마취제 침윤은 절개부위 피부 전층에 국소마취제를 침윤하는 것으로 수술절개 하기 전이나 피부봉합 후, 또는 양쪽 모두 실시하기도 한다. 안전한 뇌신경마취가 시행되지 않던 때에 개두술을 하기 위해서, 이후 각성머리뼈절개나, 만성두통치료를 위해서, 두개강 고정용 핀거치에 따른 혈역학적 반응을 줄이기 위해[57] 혹은 개두술후 통증을 줄이기 위해 실시한다. 두피신경차단을 수술 전에 실시한 경우 피부절개에 따른 침해성 반응을 차단하여 전신마취제의 요구량이 줄었고 각성이 빨랐지만, 수술 후 통증을 약하게 느끼는 시간이 6–8시간으로 수술 후에 차단했을 때의 10–12시간 보다 짧았으나, 진통제의 요구량은 차이가 없었고[59] 0.75% ropivacaine으로 수술 후에 두피신경차단한 경우 수술 후 24시간 동안 통증의 강도를 줄였는데, 이는 ropivacaine의 작용시간 보다 길었다[60]. 국소마취제 침윤의 경우 진통효과는 수술 후 1–2시간부터 24시간까지 다양하나, 일부에서는 2달 후에 측정한 통증점수를 낮춰 신경병증성통증으로 이행을 막았고[61] 0.5% ropivacaine과 1% lidocaine을 혼합한 약제를 이용하여 LAI 시술시간을 달리한 연구에서 수술 전에 시술한 경우 첫 6시간 동안 통증강도와 morphine 요구량을, 24시간 동안은 morphine의 요구량만을 줄여서 이 경우도 선행진통효과가 있음을 시사하였다[62]. 두피신경차단을 수술 전에 실시할 경우 자극과 관련된 혈역학적 반응을 줄이고 특히 고정용 핀고정에 따른 반응을 줄여주지만 수술 후까지 지속되지는 않았고[58], 핀고정할때는 적어도 5분전에 두피국소침윤을 해야 좋은 효과를 보이는데, 이때, lidocaine 국소침윤과 함께 0.5 mg/kg ketamine을 주사하면 심혈관계반응이 가장 적어진다고 한다[63]. 작용시간이 비교적 긴 bupivacaine ropivacaine과 levobupivacaine 등을 고농도로 사용하면서 작용발현시간이 짧은 lidocaine과 혼합하면 확실한 진통효과를 볼 수 있다. 혈관수축효과가 있는 ropivacaine과 달리 bupivacaine은 혈관수축을 위해 epinephrine을 첨가하는 것이 혈중 농도가 높아지는 것을 막고, 절개에 따른 실혈을 줄일 수 있지만 epinephrine이 bupivacaine의 지속시간을 늘리는지는 확실치 않고 또 심혈관계 이상반응을 유발시킬 수 있다. 국소마취제는 세포막에 작용하는데, 세균과 진균의 세포막에도 작용함으로 정균, 살균효과와 정진균, 살진균(fungistatic, fungicidal) 효과가 있어 감염의 위험을 줄여줄 수 있다[64].
두피는 혈액순환이 풍부하고 신경의 주행이 동맥과 비슷하고, 상대적으로 다량의 국소마취제를 사용하여야 하고, 뇌와 연결된 기구나 두개골의 결함이 있을 수 있기 때문에 두피신경차단에 주의가 필요하다[58]. 또 경막은 두피침윤이나 신경차단으로 마취되지 않고 남을 수 있어 주의해야 한다. 부작용은 국소 마취제의 혈중 농도가 높아져서 생기는 독성작용(경련, 급성저혈압, 심장마비) 응고장애가 있는 경우 더 잘 생기는 혈종, 감염, 신경손상 등이 있다[58]. 독성작용을 예방하기 위해 국소마취제의 일회 사용량을 제한하여야 하는데 lidocaine 은 5 mg/kg, bupivacaine과 ropivacaine 은 2.5 mg/kg (bupivacaine 175 mg/kg plain, 225 mg/kg with epinephrine, ropivacaine 225 mg/kg)이고 racemic bupivacaine과 bupivacaine 은 심독성을 유발시키므로 혈중 농도가 높아지지 않도록 주의해야 한다[58].
만성개두술후두통
만성통증은 일반적으로 수술 후 10–50%에서 발생하고 그 중 2–10%는 매우 심각한 통증을 동반하는데[27], 수술 부위 주변에서 염증반응이 지속되거나, 수술도중 손상된 말초신경으로부터 의인성 신경병증성통증에 의해 설명된다. 지속되는 염증반응은 말초 및 중추감작을 지속시키고, 신경손상은 단면에 신경종을 만들고 구심성신경손상에 따른 중추신경계의 변화(시냅스의 재배열, 억압작용의 방해에 의한 이상반응, 척수후각, 시상, 대뇌피질에서의 자발전위가 발생)를 초래하여[65,66] 신경병증성통증 양상을 갖는다. 만성통증으로 이행을 증가시키는 위험인자는 유전적으로 예민하거나, 술전에 통증이 있거나 정신사회요인(수술 전 통증에 대한 걱정과 공포, 경험, 직업 등), 젊거나 여성 등이다[66].
국제두통학회의 정의에 따르면 만성개두술후두통은 사고로 인한 뇌수술을 제외한 뇌수술 후, 7일 내에 생겨서 3개월 이상 지속하는, 여러 강도의 통증이 있지만 수술 부위가 가장 아픈 두통으로, 약간 문제가 되는 정도가 1등급, 거의 매일 계속되는 2등급, 매일 약을 먹어야 하는 3등급, 참을 수 없다고 느낄 정도를 4등급으로 나눈다[23]. 급성 두통과 비슷한 박동성 압박적 양상의 두통으로 정신적 육체적 스트레스나 기침, 자세를 바꿀 때 갑자기 생기기도 한다. 발생빈도는 0–65%로 천막위수술 후에는 비교적 낮으나(11.9%), 청신경종(acoustic neuroma) 제거 후에 36.7–49.5%로[19] 높고, 또 후두개와, 뇌기저 수술 후에도 발생 빈도가 높다. 발생의 위험을 높이는 인자들 중 환자요인으로 여성, 불안, 우울증을 앓은 경우 고빈도를 보이고, 수술적 요인으로 수술부위, 수술적 기법이 있는데 각 조직간의 유착을 줄이고 두개성형술을 실시하는 등 각각의 시술에 따른 문제점이 달라서 맞춤형 마취와 통증기전에 따른 다양한 통증관리가 필요하다. 국소마취제로 두피신경차단이나 국소마취제 침윤을, ketamine, gabapentin 등의 정맥주사도 예방효과가 있는 것으로 알려졌다. 치료는 만성통증과 신경병증성통증에 준하는데, 약물과 비약물요법 모두 실시하며, 그 중 35%는 완치되지만 1% 환자는 1년 이상 지속된다[15].
결론
개두술후 통증을 유발하는 원인과 빈도, 통증에 영향을 주는 환자 관련, 수술관련 요인들과 여러 가지 치료방법을 살펴보았다. 일반적으로 수술 후 통증치료를 하는 이유는 환자의 불안을 감소하고, 편안함을 제공하며, 자율신경계와 체신경계의 반사반응을 억제하여, 각 기관의 기능이 회복되어 활동과 음식을 섭취하도록 하여 수술 후 결과를 향상시키려는 것이다[67]. 개두술 후에는 통증으로 인한 뇌압상승이 좋지 않은 합병증을 초래할 수 있으므로 신경학적 검사와 부작용을 잘 관찰하면서 통증을 치료해야 한다. 개두술후 통증의 발생빈도는 여전히 60% 이상으로 높지만 개두술후 통증관리에 대한 필요성을 인식하고 여러 가지 시도를 해왔다.
일반 수술 후 통증관리를 위해 각각의 수술에서 최소 침습수술(minimally invasive surgical technique), 표준화된 통증평가와 치료지침과 다양한 진통기법을 각 수술에 적합하게 적용하도록 PROSPECT Web을 통해 권고하고 이를 통해 수술 후 통증을 치료하려고 애쓰고 있다.
개두술후 통증치료를 위해 다양한 진통기법을 이용한 치료지침은 아직 충분한 근거를 찾지 못하여 만들어지지 않았지만, 수술을 앞두고 개두술의 종류와 환자의 상태를 감안한 최적의 통증치료 방법을 수술에 앞서 집도의와 마취과의사가 수립하는 것이 바람직하겠다. 이를 위해서는 표준화되어 널리 통용되는 통증평가 방법을 통한 통증평가가 이루어져야 하는데 이 평가방법은 환자가 호소하는 통증에 적합한 약을 선택하도록 하고, 진통효과가 충분히 길어 환자에게 좋은 약을 선택하도록 하여야 하고, 의식상태가 명료하지 않은 환자나 소아에게도 적용될 수 있는 것이어야 하겠다. 개두술후 통증을 최소화하여 빠른 회복을 도모할 수 있도록 최소침습기술(minimal invasion technique)을 사용하고, opioids, steroids, 국소마취제를 이용한 두피신경차단, 국소마취제 침윤, 때로는 gabapentine이나 ketamine을 이용하여 예방진통효과를 위해 전신마취와 더불어 수술 후 진통을 시작하며, 아픔 없이 깨도록 하고, 수술 후에도 통증이 지속되는 동안 충분한 진통을 제공해야겠다. 아울러 국내에서도 대한뇌신경마취학회를 중심으로 개두술후 통증의 치료지침을 수립하기 위한 노력이 필요하다고 사료된다.