수술 전 dexmedetomidine의 투여가 수술 후 자가진통 조절장치에 사용되는 마약성 진통제 용량에 미치는 영향
The effect of pre-anesthetic administration of dexmedetomidine on the consumption of opioids in postoperative gynecologic patients
Article information
Abstract
Background:
This study was designed to assess whether pre-anesthetic administration of dexmedetomidine reduces the postoperative consumption of opioids, in patients receiving patient-controlled fentanyl after gynecological laparotomy.
Methods:
This was a prospective, randomized, double-blind, controlled study. Ten minutes before induction of anesthesia, 36 patients scheduled for elective gynecological laparotomy were assigned to receive either normal saline (group N) or dexmedetomidine 1 μg/kg (group D). A patient-controlled analgesia (PCA) device was used to administer fentanyl for the postoperative 24 h period. Cumulative fentanyl consumption and pain score were assessed at postoperative 30 min, 6 h and 24 h. Patient’s satisfaction for pain control and other side effects (nausea, sedation score) were recorded for all corresponding time points.
Results:
There was no significant difference between the groups in cumulative fentanyl consumption (Group N: 11.1 ± 3.2 μg/kg, Group D 10.3 ± 2.9 μg/kg, P value: 0.706). The incidence of side-effects did not differ between the groups. Both groups showed similar blood pressure after anesthesia induction. However, 10 min after anesthesia induction, the heart rates in group D were significantly lower than group N (P = 0.0002).
Conclusions:
In patients undergoing gynecological laparotomy, the pre-anesthetic administration of single loading dose dexmedetomidine (1 μg/kg) given 10 min before anesthesia induction did not reduce the PCA consumption of postoperative fentanyl or the pain score.
서론
아편유사제는 진통 효과가 있지만, 구역, 구토 및 호흡 억제와 같은 부작용을 일으킬 수 있다[1,2]. 아편유사제의 용량의존적 부작용을 줄이기 위하여 다양한 비마약성 진통제가 함께 사용되고 있으며, 이외에도 gabapentin과[3] ketamine 등[4]을 이용한 선행진통(preemptive analgesia)법이 사용되어 왔다.
Dexmedetomidine은 선택적 알파-2 아드레날린 수용체 작용제로[5], 진정효과 및 진통효과가 있고 중추적으로 교감신경계의 활동과 카테콜아민의 분비를 억제하여[6,7] 전신마취를 받는 환자에게 투여할 경우 수술 후 통증조절을 위한 아편유사제의 요구량을 감소시킨다고 알려져 있다[8,9]. 아편유사제의 요구량의 감소를 위해 dexmedetomidine을 자가진통조절장치에 첨가하거나[10], 수술 후 국소부위에 주사하는 방법이 이용된다[11].
Dexmedetomidine은 체내에서 빠르게 분포되고 간에서 광범위하게 대사되며[8], 제거 반감기가 2시간[9], 상황민감 반감기(context-sensitive half time)는 4분 이내로 보고되어 있지만[6], Unlugenc 등[12]은 마취 유도 전 1 μg/kg를 정주 하였을 때 수술 이후 24시간 동안의 아편유사제 소모량을 유의하게 감소시킨다고 보고하기도 하였다. 그러나 Naik 등[13]은 마취 유도 전뿐만 아니라 수술 중에도 지속해서 dexmedetomidine을 정주하였지만 수술 이후 24, 48, 72시간 동안 사용된 아편유사제양은 유의하게 감소하지 않았다고 보고하였다.
이처럼 dexmedetomidine의 수술 전 투여가 수술 후 자가진통조절장치를 통한 아편유사제의 소모량을 감소시키는지에 대한 상반된 연구 결과가 제시되어 있으므로 이에 대한 추가적인 연구가 필요해 보인다.
본 저자들은 마취 유도 전 사용한 dexmetomidine이 수술 후 24시간동안의 마약성진통제의 사용량을 감소시키는지를 알기 위해 예비 연구를 시행하였다.
대상 및 방법
전신마취 하에 개복적 전자궁 적출술이 계획된 환자 중 미국 마취과학회 신체등급 분류 I–II에 해당하는 25–65세 여자 환자 36명을 대상으로 하였다. 본 예비 연구에 대하여 본원의 임상연구 윤리 위원회의 승인(SPIRB-11-098)을 받았으며, 술 전 방문에서 환자에게 연구의 목적과 정맥 내 자가진통장치 사용 방법과 통증 및 부작용 평가에 사용될 NRS (numeric rating scale)에 대해 충분한 설명을 하고 동의를 받았다. 마약 만성 복용자, 만성 알코올 중독자, 만성진정 수면제 복용자, 만성 통증이 동반된 환자는 연구에서 제외하였다.
모든 환자에게 마취 전 투약으로 glycopyrrolate 0.2 mg을 근육 주사하였다. 환자는 dexmedetomidine을 투여한 군(D군)과 생리식염수를 투여한 군(N군)으로 나뉘었으며 컴퓨터 생성 난수표에 의한 무작위 배정법으로 D군에 17명, N군에 19명을 배정하였다.
환자가 수술실에 도착한 후 심전도, 자동혈압계, 맥박산소계측기를 거치하였다. D군은 dexmedetomidine 1 μg/kg를 마취 유도 10분 전에 정맥로를 통해 10분동안 지속 주입하였으며, N군은 0.9% 생리식염수를 D군과 동일한 방법으로 지속 주입하였다. 시험약 주입 직전, 주입 중 5분, 10분, 각각 비침습적 혈압, 맥박, 산소포화도를 측정하였다. 마취 유도는 신선가스 유량 5 L/min 속도로 100% 산소를 1분간 흡입 후 2% lidocaine 20 mg, propofol 2 mg/kg과 rocuronium 0.6 mg/kg를 정주한 후 기도 삽관을 하였으며, 기관 내 삽관 후에는 sevoflurane 1.5–2.5 vol% 및, N2O 50%로 유지하였고, 호기 말 이산화탄소 분압이 30–35 mmHg 수준으로 유지되도록 일회 환기량 및 호흡수를 조절하였다. 자궁이 적출된 뒤 근막을 닫을 때 fentanyl 100 μg을 정주하였다.
자가진통조절장치(AutoMed 3200®, Acemedical, Korea)는 fentanyl (Fentanyl citrate®, Hana pharm, Korea) 1,500 μg 과 ramosetron 0.3 mg, 생리식염수 68 ml를 혼합하여 총 용량 100 ml를 만들어 시간당 지속주입용량 1 ml로 하였으며, 잠금 시간은 10분, 일회 주입용량 1 ml로 설정하였다. 자가진통조절장치는 수술에서 의식 회복 후 환자가 자가진통조절장치의 단추를 임의로 누를 수 있을 정도로 각성하였을 때 주입을 시작하였다.
수술 후 30분, 6시간, 24시간이 지나서 자가진통조절장치로 투여된 fentanyl의 누적투여량, 불편감과 통증 정도는 NRS로 측정하였으며, 진정도 및 구역감의 정도도 평가하였다. 불편감은 평온한 상태를 0으로 정하고, 극도로 불편한 상태를 10으로 정한 뒤 그 정도를 평가하였으며, 통증 정도는 통증이 전혀 없는 경우를 0점, 죽고 싶을 정도의 통증을 10점으로 정하였다. 진정도는 0점을 완전히 깨어있는 상태로 정상적인 대화가 가능한 경우로 하였고, 1점은 이름을 불렀을 때 느리게 반응하는 경우로 하였으며, 2점은 큰 소리 또는 반복적으로 이름을 불러야만 반응, 3점은 몸을 흔들거나 약하게 자극을 할 때 반응, 4점은 몸을 흔들거나 약하게 자극할 때 무반응, 5점은 아픈 자극에도 반응하지 않는 경우로 하였다. 구역감은 1점은 구역감이 없는 경우, 2점은 15분 동안 1번의 구역감을 느낀 경우, 3점은 15분 동안 2–3차례의 구역감을 느낀 경우, 4점은 15분 동안 4차례이상의 구역감을 느낀 경우, 5점은 구역감에 대한 치료를 하여도 지속적인 구역감을 느끼는 경우로 하였다.
이 예비 연구의 일차끝점(primary endpoint)은 수술 후 24시간동안 사용된 아편유사제(fentanyl)의 총량을 체중으로 표준화한 값(μg/kg)이다. 표본수의 계산은 dexmedetomidine과 위약(placebo)을 사용한 두 군에서의 수술 후 아편유사제(morphine)의 사용량의 차이를 비교한 Unlugenic의 연구를 참고하였으며[12], 유의수준(α error) 5%, 검정력 80% (β = 0.2)로 수술 후 24시간 동안 사용된 fentanyl의 사용량을 약30% 감소시키기 위하여 각 군에서 필요한 환자수는 150명이었으나, 20%의 탈락 가능성을 고려하여 각 군의 환자수를 180명으로 정하였다. Hertzog [14]의 연구에 따라 총 계산된 환자수의 10%인 총 36명으로 예비 연구의 표본수를 설정한 뒤 컴퓨터생성 난수표에 의해 각 군에 배정하였다. 두 군간 fentanyl 사용량(ug/kg)의 차이는 티-검정(t-test)을 이용하였고, 불편감과 통증정도, 진정도 및 구역감의 두 군간 비교는 맨-휘트니 U 검정(Mann-Whitney U test)을 이용하였다. 두 군간 부작용(구역, 구토)의 발생빈도의 차이는 카이제곱검정(Chi-square test)을 이용하였다. 통계적 분석은 R version 3.2 (R Core Team (2016). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/)를 이용하였으며, P < 0.05인 경우 통계적으로 유의한 것으로 간주하였다.
결과
총 36명의 환자 중, D군에서 환자의 자가진통조절장치 사용거부로 인하여 1명, N군에서 수술 후 약물 알레르기 반응으로 인하여 1명이 제외되었다.
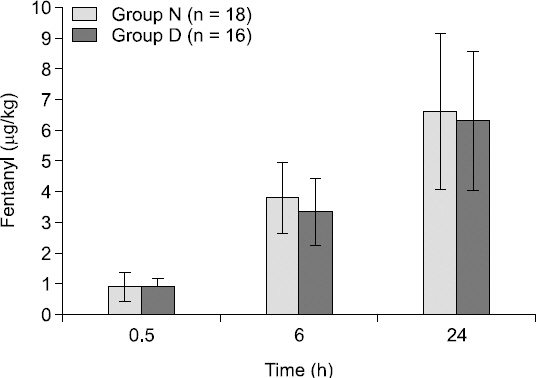
D군과 N군간의 신장, 체중, 연령에는 유의한 차이는 없었고(Table 1), 술 후 30분 동안 자가진통조절장치를 통해 사용된 fentanyl의 양은 N군은 0.8 ± 0.5 μg/kg, D군은 0.8 ± 0.3 μg/kg로 큰 차이가 없었으며, 술 후 30분-6시간 동안 자가진통조절장치를 통해 사용된 fentanyl의 양은 N군은 3.7 ± 1.2 μg/kg, D군은 3.3 ± 1.1 μg/kg, 술 후 6–24시간 동안 자가진통조절장치를 통해 사용된 fentanyl의 양은 N군은 6.6 ± 2.6 μg/kg, D군은 6.3 ± 2.3 μg/kg으로 큰 차이가 없었으며. 술 후 24시간 동안 자가진통조절장치를 통해 사용된 총 fentanyl의 양은 N군은 11.1 ± 3.2 μg/kg, D군은 10.3 ± 2.9 μg/kg으로 유의한 차이를 보이지 않았다(Fig. 1).
술 후 30분, 6시간, 24시간에 측정한 환자의 통증, 불편감, 진정, 구역감에 대한 점수에도 유의한 차이가 없었고(Table 2), dexmedetomidine의 주입 후 10분간 서맥이 실험군에서만 4차례 발생하였으나, 치료가 필요하지는 않았다(Table 3).
고찰
본 예비 연구에서 전신마취 유도 직전에 10분 동안 정맥으로 투여한 1 μg/kg의 dexmedetomidine은 수술 후 24시간 동안 자가진통조절장치를 통한 fentanyl의 사용량에 영향을 미치지 않았다.
Unlugenc 등[12]은 담낭절제술과 탈장교정술을 받는 환자에서 전신마취 직전에 10분간 1 μg/kg의 dexmedetomidine을 정맥 투여하였으며, 수술 후 모르핀을 주입한 자가진통조절장치를 사용하였고, 수술 후 24시간 동안 약 28%의 모르핀 사용량의 감소 효과를 보고하였다. Del Angel 등[15]은 탈장교정술을 받는 환자에서 부위 마취 직전에 5–10분간 25 μg의 dexmedetomidine를 정맥으로 투여하였으며 수술 후 환자의 요구에 따라 모르핀을 정맥 주사하였고, 모르핀의 요구량의 유의한 감소효과를 보고하였다.
최근 dexmedetomidine과 fentanyl의 선행진통에 대한 동물실험 연구에서는 복강내로 투여한 2–60 μg/kg의 fentanyl에 비해서 1–10 μg/kg의 dexmedetomidine이 시상에서 하강 억제 구조(descending inhibition mechanism)을 강화시킴으로 선행진통에 효과적이라고 보고하였다[16].
다른 연구에 의하면 dexmedetomidine의 투여가 미주신경 및 알파7니코틴아세틸콜린수용체-의존기전(alpha-7-nicotinic acethylcholine receptor-dependent mechanism)을 통하여 혈액내의 대표적인 전염증성사이토카인(proinflammatory cytokine)인 TNF-alpha, IL-1beta, IL-6의 감소를 야기한다는 보고가 있는데, 전염증성 사이토카인은 중추신경계와 말초신경계에 다양한 작용을 하여 염증반응을 일으키며 신경성 동통을 유발한다고 알려져 있다[17,18].
Naik 등[13]은 세 분절 이상의 척추수술을 받는 환자에서 전신마취 직전에 10분간 정맥으로 1 μg/kg의 dexmedetomidine을 투여하였고, 수술 중에도 0.5 μg/kg/hr의 속도로 지속해서 투여하였고, 술 후 24시간, 48시간, 72시간에 자가진통조절장치를 통한 fentanyl의 사용량에 유의한 차이가 없었다.
Unlugenc 등과 Del Angel 등의 연구들은 본 예비 연구와 비교해 볼 때 수술적 강도나 시간은 비슷하였지만, 자가진통조절장치의 지속주입용량을 설정하지 않았다는 차이가 있다. Naik 등의 연구에서도 자가진통조절장치에 지속주입 용량이 없었다. 그러나 Naik 등의 연구는 환자에게 4시간마다 경구로 oxycodone 5 mg을 투여하였으며, 이것이 자가진통조절장치를 통한 fentanyl 사용량에 영향을 미쳤을 것이라 생각된다.
마취 유도전 dexmedetomidine이 수술 후 자가진통조절장치를 통해 주입된 fentanyl의 사용량에 미치는 영향을 평가함에 있어서, 지속주입용량을 설정한 자가진통조절장치를 환자에게 적용하는 것은 본 예비 연구의 제한점이다. 24시간 동안 지속주입용량으로 사용된 fentanyl은 각 군에서 360 μg으로 24시간 동안 자가진통조절장치를 통해 사용된 fentanyl 용량의 N군의 55% (654 μg), D군은 62% (577 μg)에 해당한다. 이를 시간대별로 구분 지어보면 fentanyl의 소모량 중 지속주입용량에 대한 비율은 술 후 30분-6시간 동안 N군은 216.7 μg중 90 μg으로 41%, D군은 181.7 μg중 90 μg으로 49%, 술 후 6시간–24시간 동안 N군은 390.5 μg중 270 μg으로 69%, D군은 350 μg중 270 μg으로 77%이었다. 술 후 시간이 경과 할수록 환자의 통증과 불편감은 감소하였지만, 지속주입용량이 일정하게 주입됨으로 인해 환자의 fentanyl 요구량에 영향을 끼치게 되었고, 이것은 수술 후 fentanyl의 소모량의 차이가 예측했던 값인 30%에 비해, 13%로 더 작게 측정된 이유로 저자들은 추정하였다.
여러 연구에서 지속주입용량을 사용하는 것이 아편 유사제의 사용량은 증가시키지만, 진통 효과를 향상시키지는 않는다는 보고가 있었다[19-21]. 또한, 기저주입은 호흡 억제를 유발하는 위험 요인으로 알려져 있다[22,23]. 그렇지만 국내의 경우 자가진통조절장치를 사용할 때 대부분의 경우(정맥 자기진통조절장치 요법 중 약 96%)에서 지속주입용량을 사용하고 있었다[24].
그러므로 향후 연구에서는 지속주입 용량 없이 자가진통장치를 설정하여 수술 전 투여한 dexmedetomidine의 선행진통효과를 더 분명하게 나타나도록 계획 중이다.
결론적으로, 본 예비 연구에서 전신마취 시작 직전에 투여한 dexmedetomidine은 개복적 전자궁 적출술 수술 후 통증조절을 위한 fentanyl 사용량에 영향을 미치지 않았다.